- O SM
- Życie z SM
- NMOSD/MOGAD
- PTSR
- Jak pomagamy
- Chcesz pomóc?
- Specjaliści
Infolinia
+48 22 127 48 50Infolinia
+48 22 127 48 50Obecnie mimo niezwykłego postępu, który dokonał się w ostatnich latach w leczeniu stwardnienia rozsianego, nie zostało wciąż wynalezione lekarstwo, które prowadziłoby do wyleczenia z SM. Cały czas jednak trwają poszukiwania nowych, które pozwolą na jeszcze skuteczniejsze leczenie osób ze stwardnieniu rozsianym - to tzw. badania kliniczne.
Niekiedy lekarz może zaproponować osobie z SM leczenie w ramach badań klinicznych. Warto zapoznać się z podstawowymi informacjami dotyczącymi tychże badań.
Badanie kliniczne to rodzaj badania medycznego, w którym uczestnikami są ludzie. Jego celem jest przetestowanie bezpieczeństwa, działania i skuteczności nowopowstałych oraz też tych już istniejących terapii leczniczych. Każde badanie kliniczne ma ściśle określony protokół, który opisuje to, w jaki sposób badanie ma być prowadzone. Protokół oparty na szczegółowych wytycznych określonych w polskim prawie i regulacjach międzynarodowych. Opracowywany jest też zgodnie z wymaganiami Dobrej Praktyki Klinicznej (DPK). Protokół, przed rozpoczęciem badań, zatwierdzany jest przez komisję bioetyczną i odpowiednie władze.
Aby wszystko przebiegało zgodnie z przepisami, nadzór nad prowadzeniem badań klinicznych mają specjalnie do tego wybrane organy państwowe:
W badaniach klinicznych mogą wziąć udział dorosłe osoby zdrowe lub osoby z konkretnymi schorzeniami medycznymi. Nie prowadzi się badań klinicznych na kobietach ciężarnych. Uczestnicy badań klinicznych są rekrutowani na podstawie protokołu badania klinicznego, który opisuje jakie kryteria spełniać musi uczestnik, aby wziąć udział w badaniu.
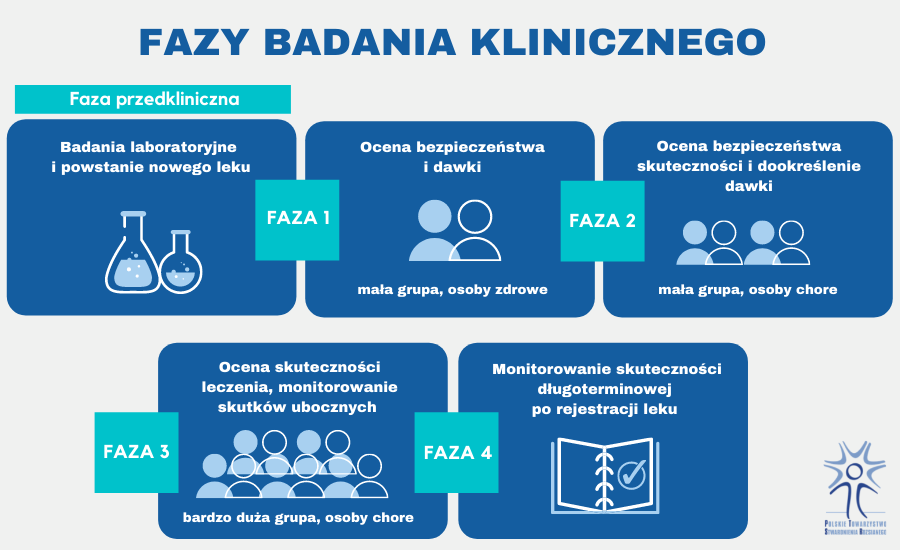
Badania kliniczne prowadzi się w wyspecjalizowanych ośrodkach, pod nadzorem specjalistów z wielu dziedzin. Każde z badań składa się z 4 faz, które opisane zostały po krótce poniżej:
Faza I obejmuje badania na małej grupie zdrowych ochotników i trwa kilka miesięcy. Ma na celu:
Faza II obejmuje badania na określonej grupie chorych, którym lek podawany jest zazwyczaj w sposób randomizowany (część osób otrzymuje produkt a część tzw. placebo). Faza ta trwa od kilku miesięcy do nawet kilku lat i jej celem jest:
Faza III dotyczy najczęściej kilkuset do kilku tysięcy osób chorych i również trwa kilka lat. Głównym celem tej fazy jest:
Faza IV badań jest prowadzona po zarejestrowaniu preparatu i wprowadzeniu go do obrotu. Bierze w niej udział liczna grupa osób, z różnych populacji. Jej celem jest:
W badaniu klinicznym prawa uczestników i ich bezpieczeństwo są najważniejsze i nadrzędne wobec innych korzyści mogących płynąć z badania. Każdy uczestnik badania klinicznego ma ściśle określone prawa: do informacji, dobrowolności udziału w badaniu, do odmowy udziału lub wycofania się z udziału, do ochrony danych osobowych, o danych dotyczących testowanego leku, do odszkodowania, do anonimowości.
Uczestnicy badania nie ponoszą kosztów jego uczestnictwa, które pokrywane są przez sponsora badania. Dodatkowo, każda osoba biorąca udział w badaniu klinicznym otrzymuje opiekę medyczną oraz badania.
Link do strony internetowej, na której znaleźć można informację o aktualnie rekrutujących (ale też zakończonych) badaniach klinicznych, m.in. w stwardnieniu rozsianym: https://clinicaltrials.gov/